Saúde
O que cientistas acham do 1º implante de chip cerebral da Neuralink

Elon Musk, CEO da Neuralink, anunciou em uma publicação no X (antigo Twitter) que o 1º chip cerebral da empresa foi implantando em 28 de janeiro, dando início aos testes em humanos. A nova etapa do desenvolvimento dos chips aconteceu depois de negativas da agência reguladora Food and Drug Administration (FDA) e deve analisar os resultados em voluntários pelos próximos seis anos.
A reação da comunidade científica foi mista. Enquanto alguns estão céticos sobre os critérios de Elon Musk no estudo, outros estão animados com as possibilidades da novidade.
Leia mais:
- Neuralink faz 1º implante de chip cerebral em humano; veja detalhes
- Não é só Elon Musk que quer implantar chips cerebrais; conheça mais empresas interessadas
- Por dentro do chip cerebral Telepathy da Neuralink
O que dizem os cientistas sobre o chip da Neuralink
Os chips cerebrais da Neuralink foram batizados de Telepathy (Telepatia) e tem o objetivo de ajudar pessoas com algum tipo de paralisia. O dispositivo é instalado por um robô em uma região do cérebro que controla o movimento, permitindo controlar eletrônicos, membros robóticos, cadeiras de rodas e mais usando apenas o pensamento.
Segundo a Nature, os cientistas da área estão cautelosos. Mariska Vansteensel, neurocientista do Centro Médico Universitário de Utrecht, nos Países Baixos, e presidente da Sociedade Internacional BCI (chips como o da Neuralink) espera que os chips sejam seguros e possam provar isso.
Além disso, a especialista espera que eles sejam eficazes a curto e, mais importante, a longo prazo, e questiona se a qualidade dos sinais captados se degrada nos chips (o que é comum) e como isso funcionará com o tempo, já que uma troca não é tão simples.
Já Tim Denison, neuroengenheiro da Universidade de Oxford, acredita que as possibilidades do chip cerebral são empolgantes “para o bem dos pacientes”. Claro, observando a segurança, “sem derrames, sem sangramentos, sem danos na vasculatura, qualquer coisa assim”.
No entanto, no geral, há frustração acerca das informações disponíveis sobre os ensaios clínicos da Neuralink. Isso porque, segundo Denison, além de um folheto recrutando voluntários, a empresa de Elon Musk não divulgou onde os implantes estão sendo feitos e quais resultados as avaliações vão monitorar.
Outro ponto é que o ensaio não está registrado no ClinicalTrials.gov, um repositório online com curadoria de Institutos Nacionais de Saúde dos EUA, onde é comum que investigações desse tipo sejam documentadas. Além disso, muitas revistas médicas exigem esse registro antes de publicar os resultados.
Para Ian Burkhart, cofundador da BCI Pioneers Coalition, a Neuralink seria muita mais benéfica se divulgasse as informações do estudo, ao invés de deixar a comunidade especulando. “Principalmente os pacientes que esperam ansiosamente por esse tipo de tecnologia para poder melhorar suas vidas”, completou.

Chip cerebral da Neuralink
- A FDA aprovou os testes em humanos para o chip cerebral da Neuralink em maio de 2023. Quatro meses depois, a companhia abriu as inscrições para voluntários.
- O teste é chamado Prime e vai durar seis anos.
- Os pacientes passarão por testes duas vezes por semana para controlar o computador usando os sinais neurais e avaliar a experiência.
- As avaliações vão investigar três pontos do chip: primeiro, o implante em si, o N1/Telepathy; segundo, o robô R1, responsável pela implantação cirúrgica do chip; e terceiro, o N1 User App, software que se conecta ao chip para transmitir os sinais cerebrais para os eletrônicos.
O post O que cientistas acham do 1º implante de chip cerebral da Neuralink apareceu primeiro em Olhar Digital.
Saúde
O ‘pulmão artificial’ que manteve paciente vivo por dias até transplante
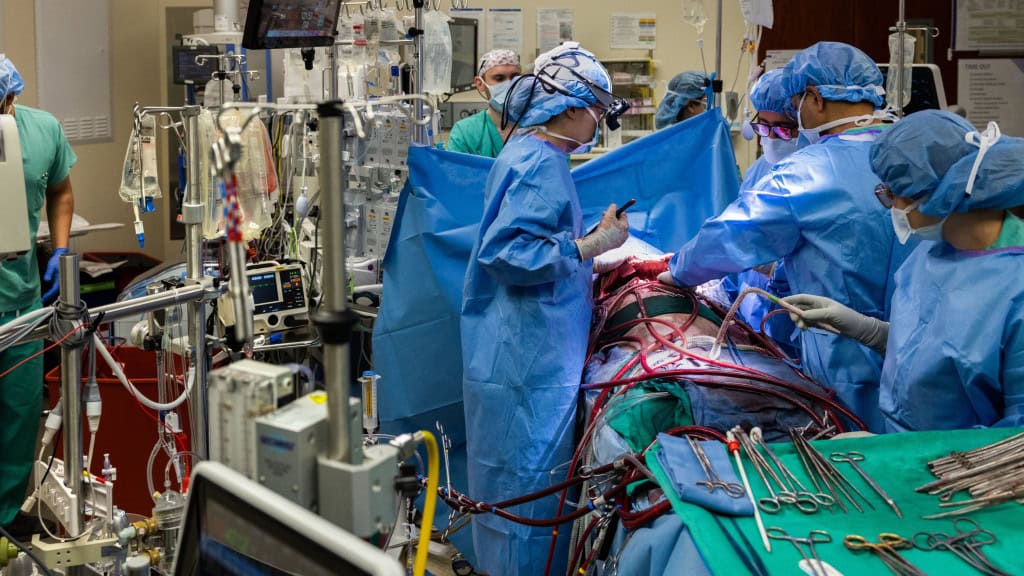
Cirurgiões conseguiram um feito inédito nos Estados Unidos: manter um paciente vivo por mais de 48 horas sem os pulmões. Como? Por meio de uma espécie de pulmão artificial, que funcionou até um doador ser encontrado.
O paciente era um homem de 33 anos. Ele tinha uma infecção grave que destruiu seus órgãos respiratórios. A solução encontrada pelos médicos foi remover os pulmões e instalar um sistema artificial temporário, que oxigenava o sangue do paciente.
Neste caso, detalhado recentemente na revista científica Med, o corpo do paciente se recuperou da infecção mais rápido após os pulmões doentes terem sido retirados. Isso mostrou que o transplante de pulmão também pode salvar pessoas com infecção aguda.
‘Pulmão artificial’ substituiu funções vitais e permitiu controle de infecção grave
O paciente desenvolveu uma inflamação pulmonar severa (SARA) após uma gripe, o que causou o acúmulo de líquidos e impediu a entrada de oxigênio no sangue. O quadro era tão crítico que os pulmões, além de não funcionarem, “alimentavam” a infecção pelo corpo e faziam outros órgãos falharem. Como o tecido estava destruído de forma irreversível, os médicos decidiram que a única chance seria a remoção total dos pulmões para eliminar o foco da doença.
Para manter o paciente vivo sem os órgãos respiratórios, a equipe conectou o corpo a um dispositivo de pulmão artificial que realizava todo o trabalho de respiração fora do corpo. Esse sistema limpava o gás carbônico e inseria oxigênio diretamente no sangue, mantendo o fluxo necessário para o coração e o restante do organismo. Assim que os pulmões doentes foram retirados, a pressão arterial estabilizou e a infecção começou a ceder, permitindo que o paciente ficasse pronto para a cirurgia.

Após a retirada, os cientistas analisaram os pulmões originais e encontraram cicatrizes profundas e danos em nível molecular que confirmaram que o órgão jamais voltaria a funcionar. O estudo mostrou que a infecção causou uma transformação definitiva no tecido, o que fez do transplante a única saída real. Essa descoberta é fundamental porque, em casos semelhantes, muitos pacientes morrem sem que o transplante seja sequer cogitado por ser considerado arriscado demais.
Dois dias após viver apenas com o suporte das máquinas, o homem recebeu o transplante de pulmão e se recuperou totalmente. Hoje, dois anos após o procedimento, ele leva uma vida normal e saudável. O sucesso dessa estratégia de “ponte” para o transplante pode não só mudar a medicina, mas oferecer uma chance de sobrevivência para casos urgentes que antes eram considerados sem esperança.
(Essa matéria também usou informações da Universidade Northwestern – aviso: a postagem tem imagens fortes.)
O post O ‘pulmão artificial’ que manteve paciente vivo por dias até transplante apareceu primeiro em Olhar Digital.
Powered by WPeMatico
Saúde
Cura do Parkinson? Estudo cria tratamento que reduz dano às células cerebrais

Uma pesquisa conduzida por cientistas da Escola de Medicina da Universidade Case Western Reserve, nos Estados Unidos, trouxe novos detalhes sobre os mecanismos celulares por trás da doença de Parkinson. A descoberta das reações bioquímicas permitiu a criação de um potencial tratamento para reduzir o dano às células cerebrais.
Após três anos de investigação, os pesquisadores identificaram como o acúmulo da proteína alfa-sinucleína pode levar à falência das mitocôndrias (responsáveis pela produção de energia nas células) e, consequentemente, à morte de neurônios essenciais.
Estudos anteriores já haviam associado o Parkinson tanto à formação de aglomerados tóxicos de alfa-sinucleína quanto à perda de eficiência das mitocôndrias. O que faltava era entender como esses dois processos se conectavam. O estudo, publicado na revista Molecular Neurodegeneration, esclareceu essa relação ao demonstrar uma interação prejudicial entre a alfa-sinucleína e a enzima ClpP, envolvida na eliminação de resíduos dentro das mitocôndrias.
De acordo com o neurocientista Xin Qi, a ligação entre as duas compromete o funcionamento das mitocôndrias, reduz a produção de energia e desencadeia efeitos típicos da doença de Parkinson, como a queda na produção de dopamina. Isso leva a danos nas células cerebrais.

Tratamento contra doença de Parkinson
Além de mapear o processo que danifica as células do cérebro, a equipe desenvolveu uma abordagem experimental para bloqueá-lo. Os cientistas criaram um pequeno fragmento proteico, batizado de CS2, que atua como uma espécie de “isca”, desviando a alfa-sinucleína da ClpP e protegendo as mitocôndrias.
Testes realizados com tecido cerebral humano, ratos e neurônios cultivados em laboratório indicaram resultados promissores: o CS2 ajudou a reduzir a inflamação no cérebro e promoveu melhora em funções motoras e cognitivas em camundongos.
Para o neurofisiologista Di Hu, o diferencial do estudo está no foco na origem do problema. “Em vez de apenas aliviar sintomas, estamos mirando um dos mecanismos centrais da doença”, afirmou.
Apesar dos avanços, os cientistas alertam que ainda será necessário um longo caminho até a aplicação clínica. A estimativa é de que ensaios em humanos só comecem em cerca de cinco anos, após avaliações rigorosas de segurança e possíveis efeitos colaterais.
O post Cura do Parkinson? Estudo cria tratamento que reduz dano às células cerebrais apareceu primeiro em Olhar Digital.
Powered by WPeMatico
Saúde
Raposas-Voadoras: saiba mais sobre a espécie que porta o vírus Nipah

O recente surto do vírus Nipah na Índia e em Bangladesh, que colocou autoridades sanitárias globais em alerta neste início de 2026, trouxe os holofotes para uma criatura fascinante e, muitas vezes, incompreendida: a raposa-voadora. Pertencentes ao gênero Pteropus, esses animais são os reservatórios naturais do vírus, mas especialistas reforçam que, diferentemente da ficção, eles não são vilões que cruzam oceanos para atacar.
Peter Neumann/Unsplash)
Em entrevista para o G1, o biólogo Roberto Leonan M. Novaes, pesquisador da Fiocruz e especialista em morcegos, explica que as raposas-voadoras são separadas das espécies brasileiras por 40 milhões de anos de evolução. Elas se orientam pela visão, possuem olhos grandes e comportamento crepuscular. O tamanho é o que mais impressiona: a espécie Pteropus vampyrus pode ultrapassar 1,80 metro de envergadura.
Distância segura e o “escudo” biológico
Uma das maiores preocupações que circulam nas redes sociais é a possibilidade de um morcego infectado voar da Ásia para o Brasil. Segundo Novaes, a resposta científica é um “não” categórico, baseado em barreiras que a natureza construiu ao longo de eras.
- Barreira Geográfica: Os oceanos Atlântico e Pacífico são intransponíveis para esses animais, que são exclusivos da Ásia, Oceania e partes da África.
- Diferença Evolutiva: A linhagem desses gigantes divergiu dos morcegos americanos há milhões de anos, resultando em fisiologias e metabolismos completamente distintos.
- Transmissão Remota: Mesmo que um humano infectado chegasse ao Brasil, a chance de transmitir o vírus para morcegos nativos (como os do gênero Artibeus) é considerada mínima pela ciência.
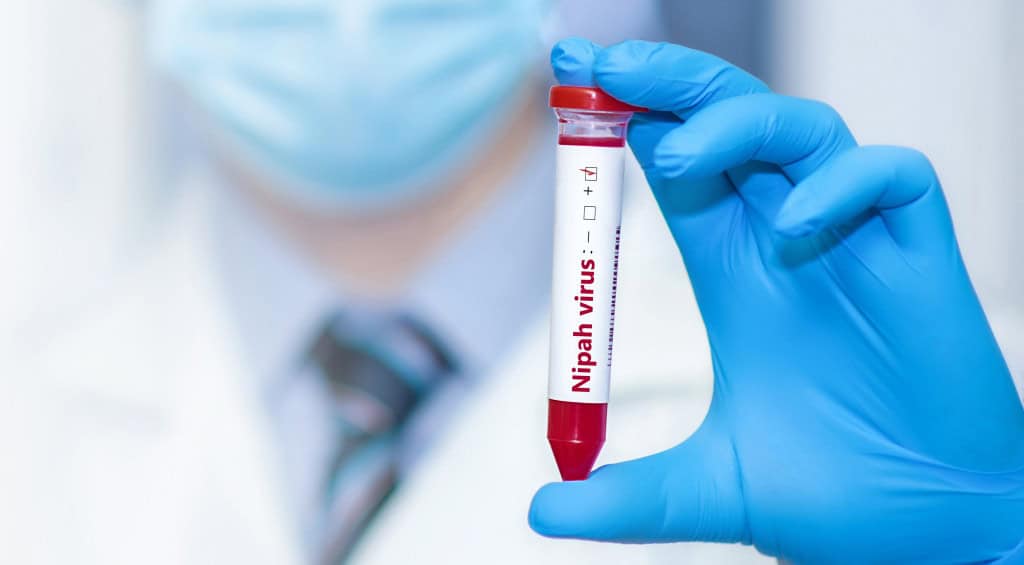
O vírus Nipah não afeta as raposas-voadoras por causa da sua imunidade. O metabolismo acelerado eleva a temperatura corporal a níveis de febre constante. Isso selecionou vírus resistentes ao calor, enquanto os morcegos desenvolveram um sistema imunológico “de elite” que suprime inflamações e recupera o DNA rapidamente, tornando-os portadores saudáveis de patógenos letais para humanos.
Leia mais:
- Entrevista: há risco de um surto do vírus Nipah?
- Conhece o Vírus Nipah? Entenda sintomas, formas de contágio e se pode chegar ao Brasil
- Há risco de um surto do vírus Nipah?
A importância da preservação ambiental
Apesar do temor gerado por novas epidemias, especialistas são unânimes: a culpa não é dos animais. O surto de Nipah está diretamente ligado à destruição de habitats e à interferência humana, como o consumo de seiva contaminada. No Brasil, os morcegos nativos desempenham papéis ecológicos vitais, como o controle de pragas agrícolas e o reflorestamento através da dispersão de sementes.
“O problema não está nos morcegos, mas na destruição das florestas. O desmatamento empurra os animais silvestres para perto das cidades”, alerta o pesquisador da Fiocruz.
Aqui no Brasil, a orientação de segurança, no entanto, permanece rigorosa para qualquer espécie: ao encontrar um morcego caído, nunca se deve tocá-lo, acionando imediatamente o Centro de Controle de Zoonoses local para evitar riscos de doenças como a raiva.
O post Raposas-Voadoras: saiba mais sobre a espécie que porta o vírus Nipah apareceu primeiro em Olhar Digital.
Powered by WPeMatico

 Tecnologia1 semana atrás
Tecnologia1 semana atrásSUV elétrico ou híbrido plug-in? Entenda o que muda na prática ao dirigir
- Negócios1 semana atrás
8 Hábitos para Fortalecer o Cérebro e Impulsionar a Carreira

 Tecnologia1 semana atrás
Tecnologia1 semana atrásCaso histórico avalia se Meta, TikTok e YouTube causam vício em jovens

 Saúde1 semana atrás
Saúde1 semana atrásAnvisa apresenta proposta para regulamentar cannabis medicinal

 Tecnologia1 semana atrás
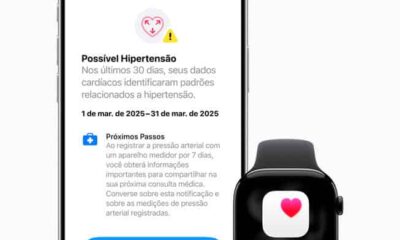
Tecnologia1 semana atrásApple libera alerta de pressão alta no Apple Watch no Brasil
- Tecnologia6 dias atrás
O efeito multiplicador: Como uma única fábrica de carros gera riqueza para o Rio inteiro

 Saúde5 dias atrás
Saúde5 dias atrásCombinação tripla elimina câncer de pâncreas em testes

 Saúde4 dias atrás
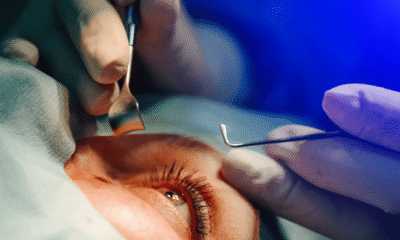
Saúde4 dias atrásCatarata: entenda como é a cirurgia que Lula fará nesta sexta-feira